前回の続き。
半導体についてもう少し踏み入って整理してみた。
電気をよく通す物質が導体。
通しにくい物質が絶縁体(不導体)。
前者の代表例は銅線などの金属。
後者の代表例はゴム。
両者の中間が半導体。
ある時は電気(電子)が流れ、ある時は流れない、その名は半導体。セミコンダクター略してセミコン。
※ コンダクター Conductor=導体。セミ Semiはセミファイナルのセミ
半導体特にトランジスタは電流のON・OFFのスイッチになるので、
ON・OFFないし強弱を「1」・「0」に割り当てればデジタル信号になり、
2進数の演算処理も可能になる。いわゆるコンピューター。
半導体の代表 珪素(シリコン)
シリコン Silicon=珪素(ケイ素) Si。半導体の代表。
シリコーン Siliconeは天然モノではなく合成モノで別モノ。シリコンゴム、シリコンオイル/シリコンスプレーのシリコンは「シリコーン」。
別物だが、どちらも原料は二酸化珪素(二酸化ケイ素) SiO2。
地上の大気の成分は窒素 N2約78%、酸素 O2約21%。
地中(地殻中)の元素は最多が酸素 Oで半分弱。次が珪素 Siで4分の1強。次がアルミニウム Al、次が鉄 Fe。
※ 地中全体だと核の大半を占めるFeが最多
地殻中の物質としてはOとSiが結合した二酸化珪素 SiO2が最多。
SiO2の結晶が石英 Quartz、水晶 Crystalで、様々な岩石に含まれている普遍的な鉱物。石英を多く占める(9割超)岩石が堆積岩のチャート。
これらが珪石(ケイ石)。砂になったものが珪砂(ケイ砂)。
半導体、シリコーン、ガラスの材料。
化学結合
珪素の他、ゲルマニウム Ge、炭化珪素 SiC、窒化ガリウム GaN、リン化ガリウム GaP、ヒ化ガリウム GaAs などが半導体。
酸化ガリウム Ga2O3や(通常は絶縁体である)ダイヤモンドも次世代半導体として研究開発中。
有機半導体もある。
元素の周期表を見ると
Si、Geが14族。ダイヤモンド(炭素 Cの同素体)も14族。
窒素 N、燐(リン) P、砒素(ヒ素) Asは15族。
Gaは13族。
酸素 Oは16族だが、
軒並み13族-15族に集中している。

原子の外側にある電子の数は水素 H 1、ヘリウム He 2、リチウム Li 3、……と1つずつ増えていって、C 6、N 7、O 8、……、Si 14、……と続く。
電子は内側から外側へ同心円状に2、8、8と規則的に配置されていく。一番内側が最大2、次が最大8、次も8。
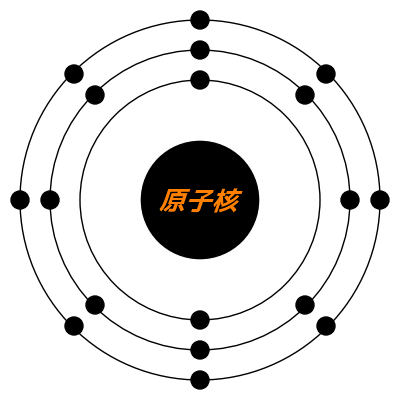
一番外側(以下、最外殻)の電子数が2、8、8の時が安定つまり不活性で、周期表の一番右の18族のヘリウム He、ネオン Ne、アルゴン Arは、化合物が作られにくい。
Sc~ZnとY~Cdは変則的だが、クリプトン Kr、キセノン Xeも最外殻の電子数が8。
※ 周期表のもう1つ下のラドン Rnも最外殻電子数8
He、Ne、Ar、Kr、Xe、Rnは希ガス
周期表の左、例えばナトリウム Na 11は、2、8、1で、最外殻の電子数は1。
周期表の右、例えば塩素 Cl 17は、2、8、7で、最外殻電子数7。
Naは、電子 e–が1つ失われると+の電気を帯びたイオン Na+になり、内側から2、8で、最外殻電子数8。
Clは、電子が1つ加わると-の電気を帯びたイオン Cl–になり、内側から2、8、8で、最外殻電子数8。
Na+とCl–が引き合って結合したものが塩(塩化ナトリウム) NaCl。
イオン結合。
炭素 Cは、電子数6で内側から2、4。
珪素 Siは、電子数14で内側から2、8、4。
いずれも最外殻電子数4。
C原子とH原子4つが結合するとメタン CH4の分子になる。
N原子とH原子3つが結合するとアンモニア NH3の分子。
SiO2のOは内側から2、6で最外殻電子数6。O原子2つとSi原子1つで互いに電子を共有。
二酸化炭素 CO2も同じ。
酸素 O2は電子4つを共有する二重結合。
みな共有結合。
イオン結合のNaClが共有結合の上記分子と違っているのは、NaCl1分子で終わらず、次々結合して結晶(イオン結晶)になる点。
Na+は複数のCl–と引き合っている。逆も然り。
これらの分子、結晶はみな通常は絶縁体。
半導体の性質を持つ結晶もある。
導体の金属は金属結合という化学結合。
追)結晶について
絶縁体の電気伝導(電導)
半導体である珪素 Siについて。
SiはSi原子1つが4つのSi原子と共有結合するが、それで終わらず、その4つのSi原子も各々別のSi原子と次々電子を共有できる。
共有結合だが分子集団。NaCl同様、目に見える結晶。
Siと同じ14族である炭素 CもC原子1つが別のC原子と次々共有結合できて、ダイヤモンドのような結晶になる。
CだけでなくH、N、Oなどの原子と次々共有結合したものが高分子の有機化合物。
SiとCは特殊。
ちなみにSi-Siの結合よりC-Cの結合のほうが強力。
Siベースの無機世界のどん詰まりがロボットで、Cベースの有機世界のどん詰まりが「我々」人間とも言えそう。
Siの結晶自体は絶縁体だが、
- 熱を加えたり
- 光を当てたり
- 不純物を加えると
電子が流れる(電気が流れる)ようになる。
熱や光を加えた場合は、
そのエネルギーによって共有結合が切れて自由になった電子が流れる。
熱センサーや光センサー、太陽電池に応用される。
不純物を加えた場合は、
例えば15族(最外殻電子数5)の砒素(ヒ素) Asを加えた場合、電子が増えて余って動き回る(電気が流れる)。
(Asは+になるが)全体としては-。n型(ネガティブ negative)の半導体。
13族(最外殻電子数3)の硼素(ホウ素) Bを加えた場合も電気が流れる。電子が奪われて、その抜け孔(ホール)に別の電子が飛び込んで、……といった具合にホールが動き回る。
※ ホールは正の電荷を持って動いているように見えるので、正孔と呼ばれるが、陽電子ではない
(Bは-になるが)全体としては+。p型(ポジティブ positive)の半導体。
n型半導体とp型半導体をくっつけて(接合して)、
エネルギー・バンド図というものが出て難しくなっていくが、ここもひとまずパスして……
電流が流れそうで流れないバランス状態(平衡状態)のデバイスが作られる。ダイオード、トランジスタ。
(順方向に)電圧を加えると
pからnへ電気が流れる(nからpへ電子が流れる)。